Inhalt

Die Prävalenz des Felinen Leukämievirus (FeLV) liegt weltweit bei 1 – 8% mit regionalen Unterschieden. Seit seiner Hochphase in Deutschland in den 1980er Jahren scheint die Prävalenz auf einem stabil niedrigen Niveau zu bleiben. So sank sie in Deutschland von 8% im Jahr 1993 auf 1% im Jahr 2002 bis 2019 (März 2017: 0,7% für Nordeuropa) [1] , und das obwohl sich die Anzahl der Hauskatzen in Deutschland in den letzten 20 Jahren mehr als verdoppelt hat, von 6,8 Millionen im Jahr 2000 auf 15,7 Millionen im letzten Jahr (2020) [2] .
Gründe hierfür sind ein verbessertes Zucht- und Hygienemanagement, die Flohprophylaxe, die hohe Rate an Einzelhaltungen (Katzen in Einzelhaltung im Jahr 2018: 58%) [2] und die reine Haushaltung, sowie eine intensivere medizinische Betreuung (häufigere Allgemeinuntersuchungen und Impfungen) und (früh)diagnostische Möglichkeiten.
Demnach scheint die Chance, eine FeLV-positive Katze als Patient anzutreffen, recht gering zu sein. Aufgrund des breitgefächerten klinischen Bildes, dem hohen Risiko an Sekundärinfektionen und der Entwicklung von Neoplasien, aber vor allem zur Prävention, sollte eine FeLV-Infektion dennoch stets differenzialdiagnostisch abgeklärt werden. Besonders gilt dies bei Mehrkatzenhaushalten oder Freigängern.
Klinisches Bild
Wie stark ein Krankheitsbild ausgeprägt ist, bzw. wie früh eine Katze an einer FeLV-Infektion stirbt, ist vor allem vom Alter des Tieres zum Zeitpunkt der Infektion abhängig. Generell zeigen jüngere Katzen schwerwiegendere Krankheitsverläufe als Katzen, die zum Zeitpunkt der Infektion älter sind. So können Katzenwelpen, die sich intrauterin infizieren, schon innerhalb der ersten 2 Lebenswochen am Fading Kitten Syndrom versterben. Betroffene Welpen sind dehydriert und zeigen eine Thymusatrophie (es müssen aber nicht alle Welpen eines Wurfes davon betroffen sein).
Klinische Symptome sind i. d. R. die Folgen der Virusvermehrung bzw. des Einbaus des Virusgenoms in die Wirtszelle und können sich unter anderem wie folgt bemerkbar machen:
- regenerative Anämien (durch Funktionsverlust der Thrombozyten, Infektion mit hämotropen Mykoplasmen)
- nicht regenerative Anämien (durch Interaktion mit Zelloberflächenrezeptoren)
- Neuropathien (durch Lymphozyteninfiltration ins Nervengewebe)
- Polyarthritiden (10% der Katzen mit Polyarthritis sind FeLV-positiv)
- Neoplasien (v. a. mediastinale oder Thymuslymphome, Fibrosarkome)
- Reproduktionsstörungen (Resorption des Fötus, später Abort)
- Hauterkrankungen (v. a. durch bakterielle Sekundärinfektionen) [3] , [4] , [5]
Infektion und Infektionsstadien
Bei der oronasalen Infektionsroute erfolgt die Übertragung von FeLV v. a. über den Speichel von FeLV-positiven Katzen. Infektiöse virale Ribonukleinsäure (RNS) wird während der Fellpflege an Partnertiere, durch Fressen und Trinken aus den gleichen Näpfen oder Bissverletzungen bei Kämpfen verbreitet. Weiterhin kann virale RNS in kleineren Mengen über Kot und die Muttermilch ausgeschieden werden. Ebenso ist die Übertragung durch Flöhe und deren Kot möglich [6] .
Nach einer erfolgreichen Infektion wird das Virusgenom in das Wirtsgenom der Katze eingebaut, dieser „Virusbauplan“ wird dann als Provirus bezeichnet. Abhängig von äußeren (z. B. Alter, Haltungsart) und inneren (z. B. Immunstatus) Einflüssen kann ein infiziertes Tier unterschiedliche Infektionsstadien durchlaufen bzw. zwischen diesen wechseln (Abb. 1) [4] , [5] .
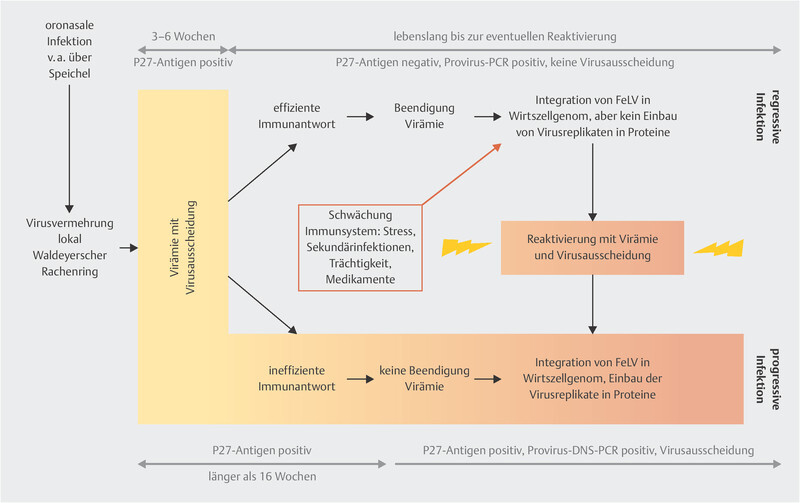
Abortive Infektion – frühere Bezeichnung „Regressor-Katzen“
Die Virusvermehrung erfolgt im oropharyngealen lymphatischen Gewebe. Ist das Immunsystem mit geeigneter Antwort aufgestellt, kann die Infektion hier gestoppt werden. In der Regel durchlaufen diese Katzen keine Virämie und haben einen hohen Titer an virusneutralisierenden Antikörpern. Frühere Studien gehen von einer totalen Viruseliminierung aus, neuere Untersuchungen vermuten, dass eine sehr geringe Viruspartikelanzahl im Körper der Katze verbleibt und so zu einem stets hohen Antikörperlevel beiträgt. Diese Art der Infektion geschieht häufig bei fäkaler Schmierinfektion [4] .
Wichtig!
Katzen mit einer abortiven Infektion sind in der Regel klinisch unauffällig und scheinen FeLV negativ zu sein. D. h. sie haben ein negatives Ergebnis auf p27-Antigen, negative Provirus-PCR und scheiden kein Virus über den Speichel aus.
Regressive Infektion – frühere Bezeichnung „transiente Virämie“
Katzen, die das Stadium einer regressiven Infektion erreichen, haben zum Infektionszeitpunkt kurz vor oder nachdem Zellen des Knochenmarks mit FeLV infiziert wurden, eine effiziente Immunantwort entwickelt. Das heißt, dass bei diesen Katzen das Virus über die Blutbahn in das Knochenmark gelangt bzw. sich über mononukleäre Zellen in verschiedene Gewebe, z. B. Speicheldrüsen, Thymus, Milz und Lymphknoten, verbreitet. Die Virämie kann 3 – 6 Wochen (max. 16 Wochen) andauern.
Daher können auch regressiv infizierte Katzen während einer kurzen Zeitspanne als FeLV-Ausscheider fungieren. Anschließend kann eine effektive Immunantwort eine weitere Virusreplikation und Virämie stoppen, sodass kein Virus mehr ausgeschieden wird. Hierbei scheinen neben FeLV-spezifischen Antikörpern auch zytotoxische T-Zellen eine Rolle zu spielen. Bei Katzen mit regressiver Infektion sind v. a. Lymphozyten und gelegentlich Monozyten mit Provirus infiziert [4] , [5].
Wichtig!
Katzen mit einer regressiven Infektion zeigen selten klinische Symptome. Betroffene Tiere können während der Virämie ein positives Testergebnis auf p27-Antigen, eine positive Provirus-PCR und positive virale RNS-PCR (im Speichel) haben.
Nach dem Ende der Virämie ist bei diesen Katzen ein negatives Testergebnis auf p27-Antigen, eine positive Provirus-PCR und eine negative virale RNS-PCR (im Speichel) zu erwarten. Vor allem bei Blutspenderkatzen ist zu überprüfen, ob diese regressiv infiziert sind, da auch FeLV-Provirus in der Transfusionslösung eine Infektionsquelle für den Empfänger darstellt.
Progressive Infektion – frühere Bezeichnung „persistierende Virämie“
Katzen mit einer progressiven Infektion zeigen eine langanhaltende Virämie von rund 16 Wochen und bleiben anschließend virämisch, gekoppelt mit einer anhaltenden Virusausscheidung über Speichel und Kot. Das Immunsystem dieser Katzen kann keine effiziente Immunantwort gegen das Virus aufbauen. Es werden Zellen des Knochenmarks infiziert, z. B. Thrombozyten(-Vorläuferzellen), Granulozyten, Monozyten, die das Virus verteilen, z. B. in Milz und Lymphknoten.
Vor allem junge und immunsupprimierte Katzen haben ein hohes Risiko, eine progressive Infektion zu entwickeln. Tiere mit einer regressiven Infektion können durch stressinduzierende- und immunsupprimierende Faktoren in ein progressives Infektionsstadium wechseln.
Wichtig!
Im progressiven Infektionsstadium ist ein positiver p27-Antigen Test, eine positive Provirus-PCR und eine positive virale-RNS-PCR (im Speichel) zu finden.
Katzen mit einer progressiven Infektion sind i. d. R. klinisch auffällig, v. a. durch Symptome von Sekundärerkrankungen (z. B. hämotrope Mykoplasmen). Eine Unterscheidung zwischen einer regressiven und progressiven Infektion kann nur durch mehrfache Nachtestung des Antigen-Tests und Provirus-PCR festgestellt werden. In der frühen Infektionsphase (erste 3–6 bis max. 16 Wochen) sind eine regressive und progressive Infektion anhand von Labortests i. d. R. nicht zu unterscheiden [4].
Fokale oder atypische Infektion
Die fokale oder atypische Infektion ist als sehr selten beschrieben. Hierbei findet nur lokal, als isolierte Vermehrungsquellen, eine Virusreplikation in einzelnen Organen statt, z. B. Auge, Milchdrüse oder Harnblase. Bei dieser Verlaufsform können z. B. klinisch unauffällige Katzen trotz negativem p27-Antigen-Test, Virusmaterial über die Muttermilch an ihre Welpen weitergeben.
Wichtig!
Katzen mit einer atypischen Infektion sind i. d. R. klinisch unauffällig. Diese Infektion ist schwierig zu detektieren, da es wegen des niedrigen p27-Antigenspiegels im Blut zu falsch negativen Ergebnissen kommen kann. Zudem wird das Virusmaterial i. d. R. nur in Körpersekreten nachgewiesen (Milch, Harn) [2] .
Diagnostik
Für die Diagnostik einer FeLV-Infektion stehen verschiedene Testverfahren, die unterschiedliche Virusbausteine nachweisen können, zur Verfügung (Tab. 1). Welcher Test und wie viele Wiederholungen nötig sind, ist auch vom Alter der Katze abhängig. So können Kitten, die intrauterin/während der Geburt infiziert wurden, viele Wochen nach der Geburt in jeglichen Tests negativ bleiben, sodass erst nach mehreren Monaten eine sichere Diagnose gestellt werden kann.
| p27-Antigen-Test | Provirus-PCR | Interpretation | Nachtestung | ||||||
|---|---|---|---|---|---|---|---|---|---|
| Start | 3 – 6 Wo | 16 Wo | PCR getestet* | Ergebnis | infiziert? | Infektionsstatus? | nötig? | welcher Test? | wann? |
| 1. Test | 2. Test | 3. Test | |||||||
| negativ | negativ | negativ | nein | - | k. A. | frei/regressiv/abortiv | ja | PCR | direkt |
| negativ | negativ | negativ | ja | positiv | ja | regressiv | - | p27** | schlechte Klinik |
| negativ | negativ | negativ | ja | negativ | nein | frei/abortiv | - | - | bei neuer Exposition |
| negativ | positiv | negativ | nein | - | k. A. | falsch positiv/akut | ja | PCR/p27+PCR | PCR direkt/beide nach 3 – 6 Wochen |
| negativ | positiv | negativ | ja | negativ | k. A. | falsch positiv/akut | ja | p27+PCR | beide nach 3 – 6 Wochen |
| negativ | positiv | negativ | ja | positiv | ja | evtl. regressiv | - | p27** | schlechte Klinik |
| positiv | negativ | negativ | nein | - | k. A. | falsch positiv/regressiv | ja | PCR/p27+PCR | PCR direkt/beide nach 3 – 6 Wochen |
| positiv | negativ | negativ | ja | negativ | nein | evtl. falsch positiv | ja | p27+PCR | beide nach 3 – 6 Wochen |
| positiv | negativ | negativ | ja | positiv | ja | regressiv | - | p27** | schlechte Klinik |
| positiv | negativ | positiv | nein | - | k. A. | evtl. progressiv | ja | PCR/p27+PCR | PCR direkt/beide nach 3 – 6 Wochen |
| positiv | negativ | positiv | ja | positiv | ja | progressiv | nein | - | - |
| positiv | positiv | negativ | nein | - | k. A. | evtl. regressiv | ja | PCR/p27+PCR | PCR direkt/beide nach 3 – 6 Wochen |
| positiv | positiv | negativ | ja | positiv | ja | regressiv | - | p27** | nach 3 – 6 Wochen/schlechte Klinik |
| positiv | positiv | positiv | nein | - | ja | evtl. progressiv | ja | PCR | PCR direkt |
| positiv | positiv | positiv | ja | positiv | ja | progressiv | nein | - | - |
p27-Antigen-Test: ELISA oder Snap-Test
Der Nachweis vom Virusantigen p27 (Kapselprotein) mittels ELISA oder Snap-Test deutet auf eine Virämie hin. Die meisten Katzen zeigen innerhalb von 28 Tagen nach der Infektion (post infectionem, p. i.) einen positiven p27-Antigen-Test. Frühester Zeitpunkt des Antigennachweises sind 7 Tage p. i.
Allgemeine Richtlinie der Testung: 3 – 6 Wochen nach infektiösem Kontakt, Wiederholung nach 10 Wochen.
negativer p27-Antigen-Test:
Dies kann bedeuten, dass die Katze …
- nicht infiziert ist,
- eine abortive Infektion hat,
- eine regressive Infektion, aber keine Virämie hat. Es weisen ca. 5 – 10% der Katzen mit negativem p27-Antigen-Test eine positive Provirus-PCR auf, da aufgrund geringer Virusreplikation der Antigen-Test falsch negativ sein kann.
- zu früh nach Infektion getestet wurde und noch nicht virämisch ist.
positiver p27-Antigen-Test:
Dies kann bedeuten, dass die Katze …
- virämisch ist: Entweder in der frühen Phase einer regressiven Infektion oder in der persistierenden Virämie einer progressiven Infektion.
- nicht infiziert ist. Falsch positive Ergebnisse sind z. B. bei der Nutzung von hämolytischem Probenmaterial möglich.
Wichtig!
Positive Ergebnisse sollten unbedingt mit einem Abstand von 6 Wochen nachgetestet werden.
Aufgrund der niedrigen Prävalenz ist die Wahrscheinlichkeit eines falsch positiven Ergebnisses höher als die Wahrscheinlichkeit, dass die Katze infiziert ist. Dennoch sollte eine Katze mit einem positiven p27-Antigen-Test von anderen Katzen separiert werden, da i. d. R. FeLV-virämische Katzen virale RNS über den Speichel ausscheiden und somit eine potenzielle Infektionsquelle darstellen.
Virale RNS-PCR: Speichel oder EDTA-Blut
Hierbei wird RNS des Virus aus Speichel- oder EDTA-Blutproben mittels PCR nachgewiesen. Ein positives Ergebnis ist ein Hinweis auf eine bestehende Virusreplikation in der Katze. Im Speichel kann bereits 1 Woche nach FeLV-Infektion RNS nachgewiesen werden. Sammelspeichelproben von Katzengruppen können hilfreich sein, um schnell und effizient Ausscheider zu identifizieren.
negative RNS-PCR (Speichel):
Dies kann bedeuten, dass die Katze …
- nicht mit FeLV infiziert ist,
- in einer regressiven Infektionsphase ist,
- zu früh nach einer potenziellen FeLV-Infektion getestet wurde.
positive RNS-PCR (Speichel): Dies bedeutet, dass die Katze als Ausscheider anzusehen ist und nur noch im Haus gehalten werden sollte. Ein positives PCR-Ergebnis ist somit beweisend für die Virusausscheidung und kann zum Ausschluss eines falsch positiven p27-Antigen-Tests genutzt werden. Eine einzeln durchgeführte PCR gibt keinen Rückschluss auf das Infektionsstadium der Katze. Eine Nachtestung nach ca. 6 Wochen ist nötig.
Provirus-PCR: EDTA-Blut
Die Provirus-PCR weist eingebautes Virusgenom, das mittels wirtseigener Enzyme in DNS umgewandelt wurde, in infizierten Zellen des Blutes nach. Der Test kann frühestens ca. 1 – 2 Wochen nach FeLV-Kontakt durchgeführt werden.
negative Provirus-PCR:
Dies kann bedeuten, dass die Katze …
- nicht infiziert ist,
- zu früh nach potenzieller FeLV-Exposition getestet wurde.
positive Provirus-PCR: Dies bedeutet, dass die Katze mit FeLV infiziert ist. Anhand des PCR-Ergebnisses ohne gleichzeitigen p27-Antigen-Test kann keine Aussage darüber getroffen werden, in welcher Infektionsphase (regressiv oder progressiv) sich die Katze befindet. Jüngeren Studien zufolge weisen Katzen mit einer regressiven Infektion niedrigere Provirusgehalte auf als Katzen mit einer progressiven Infektion, dieser Gehalt lässt sich mittels PCR abschätzen [6].
FeLV-Antikörper
Eine Antikörpermessung ist zum Nachweis einer FeLV-Infektion nicht sinnvoll, da in der Katzenpopulation viele Katzen Antikörper, aber einen negativen p27-Antigen-Test oder eine negative Provirus-PCR haben. Da keine Unterscheidung zwischen „Impf- und Feldvirusantikörper“ möglich ist, kann der Ursprung nicht ermittelt werden.
Tiermedizinische Betreuung einer FeLV-positiven Katze
Oberste Priorität hat der Verzicht auf Glukokortikoide und andere immunsuppressive Medikamente, die die Chemotaxis der Granulozyten und somit die Phagozytose herabsetzen. Um frühzeitig eine Verschlechterung des Allgemeinbefindens z. B. durch Sekundärinfektionen festzustellen, sollten FeLV-positive Katzen mindestens alle 6 Monate einer klinischen Allgemeinuntersuchung mit evtl. weiterführender Diagnostik, z. B. einem Blutbild unterzogen werden. Vor allem bei fieberhaften Beschwerden sollte immer nach einem weiteren Agens gesucht werden. Weiterhin ist eine Kastration anzuraten, damit der Reproduktionsstress entfällt [7].
Antivirale Therapie
Bislang existiert kein Goldstandard für die Therapie einer FeLV-positiven Katze. Auch wenn die Humanmedizin einige erfolgreiche Behandlungsprotokolle für das Humane Immundefizienzvirus (HIV) entwickelt hat, sind in der Tiermedizin v. a. im Bereich der Nebenwirkungen noch viele Fragen offen.
Verschiedenste Studien wurden z. B. mit Interferon-Applikation durchgeführt. Die Zytokingruppe der Interferone kann antiviral, antiproliferativ und immunmodulatorisch wirken. Im Falle der Typ-I-Interferone, zu der Interferon-Ω und -α gehören, überwiegt die antivirale Wirkweise. Hierbei werden Synthese-Mechanismen der Wirtszelle gestoppt. Bei oraler Gabe werden Interferone im Magen bzw. Dünndarm durch Trypsin inaktiviert, sodass bei dieser Verabreichungsform lediglich von einer Wirkung im Waldeyerschen Rachenring auszugehen ist. Aufgrund unterschiedlichster Ergebnisse verschiedener Studien ist eine erfolgreiche Wirkung bei FeLV-infizierten Katzen noch als fraglich anzusehen [4] , [7] .
In mehreren In-vitro-Studien und Feldversuchen wurde die Wirkung von Inhibitoren der Reverse-Transkriptase, z. B. Zidovudin, Didanosin, Zalcitabin, Foscarnet oder Ribavirin untersucht. Die antivirale Wirkung scheint in vitro nachweisbar, jedoch fehlen viele Daten zur klinischen Anwendung in der Katze, v. a. im Bereich des Nebenwirkungsspektrum. In Studien mit Zidovudin konnte z. B. eine dosisabhängige Anämie beobachtet werden.
Impfung
Impfstoffe gegen FeLV induzieren zwar keinen absoluten Impfschutz, können aber helfen, die Prävalenz zu reduzieren und bei manchen Katzen die Entstehung einer progressiven Infektion zu verhindern.
Merke
Ungeimpfte Katzen mit Bisswunden weisen eine 7,5mal höhere Wahrscheinlichkeit einer FeLV-Infektion auf als geimpfte Katzen [7] .
Vor der FeLV-Impfung ist es ratsam, den Infektionsstatus einer Katze zu klären. Denn eine FeLV-positive Katze sollte nicht mehr mit FeLV-Impfstoff geimpft werden. Hier zeigt die Impfung keinen klinischen Nutzen, aber Nebenwirkungen erscheinen kritischer.
Impfstoffe gegen felines Parvo-, Herpes und Calicivirus können verabreicht werden. Aufgrund der mangelnden Antikörperproduktion bei FeLV-positiven Katzen kann ein kürzeres Impfintervall von ca. 6 Monaten hilfreich sein, um ausreichend hohe Antikörperspiegel zu erhalten [7].
Haltungs- und Hygienemanagement
Besteht der Verdacht einer FeLV-Infektion, sollte der Katze jeglicher Freigang verwehrt werden, um die infizierte Katze vor lebensbedrohlichen Sekundärinfektionen (hämotrope Mykoplasmen, Abszessen) zu schützen und eine Ausbreitung des Virus zu reduzieren. Die Katze sollte bis zum Lebensende in Einzelhaltung oder in einer kleinen stabilen Katzengruppe ohne Neuzugang gehalten werden.
Viruspartikel sind nur wenige Minuten in der Umwelt stabil und sensibel auf Hitze, Trockenheit, jegliche Detergenzien und Desinfektionsmittel. Sie verlieren daher schnell ihre Infektiosität. Dennoch haben FeLV-freie Katzen ein Risiko von ca. 30%, bei Einführung einer FeLV-positiven Katze in den Bestand FeLV-assoziierte Erkrankungen zu entwickeln. Die Bildung von FeLV-positiven und -negativen Untergruppen im Bestand kann sinnvoll sein, ist aber nur durch mehrmalige Nachtestung aller Katzen möglich.
Weiterhin sollten einer FeLV-positiven Katze kein rohes Fleisch, keine rohen Eier oder nicht pasteurisierte Milch verfüttert werden.
Take Home
- zur sicheren Diagnose einer FeLV-Infektion sind mehrere Nachtestungen nötig:
- p27-Antigen-Test → 3 – 6 Wochen später: p27-Antigen-Test → 10 Wochen später: p27-Antigen-Test, gekoppelt mit Provirus-PCR, um Tiere, die nicht in der Virämiephase sind, zu ermitteln
- Katzen mit positivem p27-Antigen-Test scheiden i. d. R. viel infektiöses Virusmaterial über den Speichel aus
- mittels RNS-PCR-Test aus Speichel kann die Ausscheidung überprüft werden
- jüngere Katzen haben eine höhere Wahrscheinlichkeit, eine progressive Infektion zu entwickeln
- Katzen mit positivem p27-Antigen-Test von anderen Katzen isolieren und Freigang verwehren
- bei einem Nachweis von hämotropen Mykoplasmen oder Felinem-Immundefizienz-Virus sollte eine FeLV-Infektion diagnostisch abgeklärt werden
Der Originalbeitrag zum Nachlesen:
Wittauer E. Felines Leukämievirus – Einmal (testen) ist keinmal (testen)!.kleintier konkret 2021; 24(05): 26 - 32. doi:10.1055/a-1577-0457
(IR)
- Studer N, Lutz H, Saegermann C. et al. Pan-European Study on the Prevalence of the Feline Leukeamia Virus infection – Reported by the European Advisory Board on Cat Diseases (ABCD Europe). Viruses 2019; 11: 993
- Ohr R. Ökonomische und soziale Bedeutung der Heimtierhaltung in Deutschland, (September 2019). Im Internet (Stand: 19.07.2021): www.uni-goettingen.de/de/document/download/52bbce3b8ebcfef2faa77d50d72a0b21.pdf/Heimtierstudie 2019 final korr..pdf (Zugriff: )
- Hartman K. Clinical aspects of feline immunodeficiency and feline leukemia virus infection. J Vetimm 2011; 143: 190-201
- Hartmann K. Feline Leukemia Virus Infection. In: Greene CE, Duncon L, Hrsg. Infectious Diseases of the dog and cat. United States of America: Elsevier; 2012: 108-136
- Hofmann-Lehmann R, Hartmann K. Feline Leukamie virus infection A practical approach to diagnosis. JFMS 2020; 22: 831-846
- Hofmann-Lehmann R, Huder JB, Gruber S. et al. Feline Leukaemia provirus load during the course of experimental infection and in naturally infected cats. J Gen Virol 2001; 82: 1589-1596
- Little S, Levy J, Hartmann K. et al. 2020 AAFP Feline Retrovirus Testing and Management Guidelines. JFMS 2020; 22: 5-30



